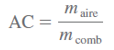Se estudian
sistemas cuya composición química cambia durante un proceso, es decir, sistemas
que implican reacciones químicas. Para trabajar con sistemas no
reactivos es necesario considerar sólo la energía interna sensible (asociada
con los cambios de presión y temperatura) y la energía interna latente (asociada
con los cambios de fase). Pero cuando se trabaja con sistemas reactivos también
se debe considerar la energía interna química, energía asociada a la
destrucción y la formación de enlaces químicos entre los átomos.
- COMBUSTIBLES Y COMBUSTIÓN
Cualquier material
que puede quemarse para liberar energía recibe el nombre de combustible.
La mayoría de los combustibles conocidos se componen principalmente de
hidrógeno y carbono. Reciben el nombre de combustibles hidrocarburos y
se denotan por la fórmula general CnHm. Los combustibles
hidrocarburos existen en todas las fases, y algunos son el carbón, la gasolina
y el gas natural.
Una reacción
química durante la cual se oxida un combustible y se libera una gran cantidad
de energía recibe el nombre de combustión. El oxidante empleado con
mayor frecuencia en los procesos de combustión es el aire, por obvias razones
(es gratuito y se consigue fácilmente).
Durante un proceso de combustión los componentes que existen antes de la reacción reciben el nombre de reactivos, y los componentes que existen después de la reacción se denominan productos.
Durante un proceso de combustión los componentes que existen antes de la reacción reciben el nombre de reactivos, y los componentes que existen después de la reacción se denominan productos.
Nota: Debe mencionarse que poner un
combustible en estrecho contacto con el oxígeno no es suficiente para iniciar
la combustión. De otro modo, el mundo entero estaría en llamas.
Una cantidad
utilizada frecuentemente en el análisis de procesos de combustión para cuantificar
las cantidades de combustible y aire es la relación aire-combustible,
AC. Suele expresarse en una base de masa y se define como la relación entre
la masa del aire y la masa de combustible en un proceso de combustión. Es
decir,
- PROCESOS DE COMBUSTIÓN TEÓRICA Y REAL
Muchas veces es
muy útil estudiar la combustión de un combustible con la suposición de que la
combustión es completa. Un proceso de combustión está completo si todo
el carbono en el combustible se transforma en CO2, todo el hidrógeno se
transforma en H2O y todo el azufre (si lo hay) se transforma en SO2. Esto es,
todos los componentes combustibles de un combustible se queman totalmente
durante un proceso de combustión completa.
Por el contrario, un proceso de combustión es incompleto si los productos de combustión contienen algo de combustible o componentes no quemados, como C, H2, CO, o bien, OH. El oxígeno insuficiente es una razón obvia para la combustión incompleta, pero no la única. También puede suceder incluso cuando en la cámara de combustión hay más oxígeno del necesario para la combustión completa.
- ENTALPIA DE FORMACIÓN Y ENTALPÍA DE COMBUSTIÓN
Se ha mencionado
que las moléculas de un sistema poseen energía en diversas formas, como la energía
sensible y la latente (asociadas a un cambio de estado), la energía
química (relativa a la estructura molecular) y la energía nuclear (vinculada
con la estructura atómica). Pero ahora
no interesa tratar con la energía nuclear.
Si se supone que
los átomos de cada reactivo permanecen intactos (sin reacciones nucleares) y se
ignora cualquier cambio en las energías cinéticas y potenciales, el cambio de
energía de un sistema durante una reacción química se deberá a un cambio en el
estado, y a un cambio en la composición química. Es decir,
Por consiguiente,
cuando los productos formados durante una reacción química salen de la cámara
de reacción en el estado de entrada de los reactivos, se tiene ΔEestado
= 0 y, en este caso, el cambio de energía del sistema se debe tan sólo a los
cambios de su composición química.
De acuerdo con la
relación de balance de energía para flujo estacionario la transferencia de
calor durante el proceso (que no incluye interacciones de trabajo) debe ser
igual a la diferencia entre la entalpía de los productos y la entalpía de los
reactivos. Es decir,
- ANÁLISIS DE SISTEMAS REACTIVOS CON BASE EN LA PRIMERA LEY
El balance de
energía (o primera ley) es aplicable por igual a sistemas reactivos y no
reactivos. Sin embargo, los sistemas químicamente reactivos implican cambios en
su energía química, en forma tal que los cambios en las energías químicas se
expresen de modo explícito, lo que se hace en esta sección primero para
sistemas de flujo estacionario, y luego para sistemas cerrados.
Sistemas de flujo
estacionario
Se necesita
expresar la entalpía de tal manera que sea relativa al estado de referencia
estándar y que el término de la energía química aparezca explícitamente. Cuando
se expresa de manera adecuada, el término de entalpía debe reducirse a la
entalpía de formación, en el estado de referencia estándar. Con
esto en mente, se expresa la entalpía de un componente por unidad de mol como
Sistemas cerrados
La relación
general de balance de energía para un sistema cerrado Eentrada - Esalida
= Esistema se expresa para un sistema cerrado químicamente reactivo
en reposo como
Donde Uprod
representa la energía interna de todos los productos, y Ureact es la
energía interna de los reactivos. Para evitar el uso de otra propiedad (la
energía interna de formación se utiliza la definición de entalpía) y
se expresa la ecuación anterior como
Donde hemos tomado
la transferencia de calor hacia el sistema y el trabajo realizado por
el sistema como cantidades positivas.
- TEMPERATURA DE FLAMA ADIABÁTICA
En ausencia de cualquier interacción de trabajo y cambios cualesquiera en las energías cinética y potencial, la energía química liberada durante un proceso de combustión se pierde como calor hacia los alrededores o se usa internamente para elevar la temperatura de los productos de combustión. En el caso límite en que no haya pérdida de calor hacia los alrededores (Q = 0), la temperatura de los productos alcanzará un máximo, conocido como temperatura de flama adiabática o de combustión adiabática.
Note que la temperatura de flama adiabática de
un combustible no es única. Su valor depende de: 1) el estado de los reactivos,
2) el grado al que se completa la reacción y 3) la cantidad de aire utilizado.
- CAMBIO DE ENTROPÍA DE SISTEMAS REACTIVOS
El análisis
termodinámico de un proceso resulta incompleto sin el examen de los aspectos de
la segunda ley. De particular interés resultan la exergía y la destrucción de
exergía, las cuales se relacionan con la entropía. El balance de entropía para
cualquier sistema (incluyendo los sistemas reactivos) que experimenta cualquier
proceso se expresa como
- ANÁLISIS DE SISTEMAS REACTIVOS CON BASE EN LA SEGUNDA LEY
Donde T0 es la temperatura absoluta de los alrededores. Cuando se analizan sistemas reactivos se tiene más interés por los cambios en la exergía de los sistemas reactivos que en los valores de exergía en varios estados.
Recordando que el trabajo reversible Wrev representa el trabajo máximo que puede efectuarse durante un proceso. En ausencia de cualquier cambio en las energías cinética y potencial, la relación del trabajo reversible para un proceso de combustión de flujo estacionario que incluye transferencia de calor únicamente con los alrededores a T0 puede obtenerse reemplazando los términos de entalpía.