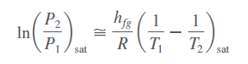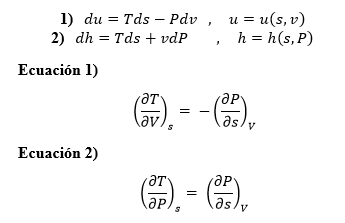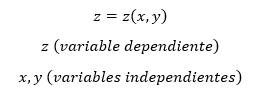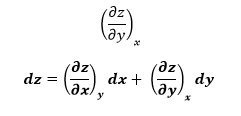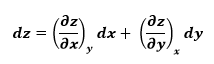Cuando un fluido pasa por un obstáculo como un tapón poroso, un tubo
capilar o una válvula ordinaria, disminuye su presión. La entalpía del fluido
permanece aproximadamente constante durante tal proceso de estrangulamiento. Un
fluido puede experimentar una reducción considerable de su temperatura debido
al estrangulamiento, lo que constituye la base de operación en los
refrigeradores y en la mayor parte de los acondicionadores de aire. Sin
embargo, esto no siempre sucede. La temperatura del fluido puede permanecer
invariable o es posible incluso que aumente durante un proceso de
estrangulamiento.
Cuando un fluido pasa por un obstáculo como un tapón poroso, un tubo
capilar o una válvula ordinaria, disminuye su presión. La entalpía del fluido
permanece aproximadamente constante durante tal proceso de estrangulamiento. Un
fluido puede experimentar una reducción considerable de su temperatura debido
al estrangulamiento, lo que constituye la base de operación en los
refrigeradores y en la mayor parte de los acondicionadores de aire. Sin
embargo, esto no siempre sucede. La temperatura del fluido puede permanecer
invariable o es posible incluso que aumente durante un proceso de
estrangulamiento.
El comportamiento
de la temperatura de un fluido durante un proceso de estrangulamiento (h=constante)
está descrito por el coeficiente de Joule-Thomson, definido como
El coeficiente de
Joule-Thomson es una medida del cambio en la temperatura con la presión durante
un proceso de entalpía constante. Observe que si
Durante un proceso
de estrangulamiento.
Un examen cuidadoso
de la ecuación con la que se define, revela que el coeficiente de Joule-Thomson
representa la pendiente de las líneas h = constante en un diagrama T-P.
Dichos diagramas pueden construirse con facilidad a partir de mediciones de
temperatura y presión durante los procesos de estrangulamiento.
El experimento se repite
para tapones porosos de diferentes tamaños, cada uno de ellos con un conjunto
diferente de T2 y P2. Al graficar las temperaturas con las
presiones se obtiene una línea de h = constante sobre un diagrama T-P,
como se muestra en la figura.
Con la repetición
del experimento para diferentes conjuntos de presión y temperatura de entrada y
graficando los resultados, se construye un diagrama T-P para una
sustancia con varias líneas de h = constante, tal como se indica en la
figura.
La línea que pasa
por estos puntos recibe el nombre de línea de inversión, y la
temperatura en un punto donde la línea de entalpía constante interseca la línea
de inversión se conoce como temperatura de inversión. La temperatura es
la intersección de la línea P = 0 (eje de ordenadas) y la parte superior
de la línea de inversión recibe el nombre de temperatura máxima de inversión.
Observe que la pendiente de las líneas de h = constante son negativas ( uJT uJT > 0) a la izquierda de ésta.
Se desarrolla una
relación general para el coeficiente de Joule-Thomson en términos de los
calores específicos, la presión, el volumen y la temperatura. Esto se logra con
facilidad modificando la relación generalizada para el cambio de entalpía.
Para un proceso de
h = constante tenemos dh = 0. Así, esta ecuación puede
reacomodarse para dar
Que es la relación
deseada. De este modo, el coeficiente de Joule-Thomson se determina a partir
del conocimiento del calor específico a presión constante, y del comportamiento
P-v-T de la sustancia. Desde luego, también es posible
predecir el calor específico a presión constante de una sustancia utilizando el
coeficiente de Joule-Thomson, el cual se determina de una forma relativamente
sencilla, con los datos P-v-T de la sustancia
FUENTE: Cengel, Yunus .A. & Boles, Michael A. (2011). Termodinámica. México: Mcgraw - Hill
INVESTIGACIÓN
¿Se puede obtener energía a partir de la variación de temperatura?
si se puede obtener y se debe a un fenómeno el dice que "Los dispositivos termoeléctricos se basan en el hecho de que cuando ciertos materiales son calentados, generan un voltaje eléctrico significativo. Por el contrario, cuando se les aplica un voltaje, se vuelven más calientes en un lado, y más fríos en el otro. Los electrones se mueven del extremo caliente del material al extremo frío, creando electrodos positivos y negativos y con ello el voltaje eléctrico. Este efecto, conocido como Peltier–Seebeck, es reversible. Esto no se produce en todos los materiales ya que, por ejemplo, el filamento de las bombillas incandescentes produce calor al aplicarle una diferencia de voltaje (efecto Joule), pero no es un efecto reversible" a esto se le llama efecto termoeléctrico.
FUENTE: Cengel, Yunus .A. & Boles, Michael A. (2011). Termodinámica. México: Mcgraw - Hill
INVESTIGACIÓN
¿Se puede obtener energía a partir de la variación de temperatura?
si se puede obtener y se debe a un fenómeno el dice que "Los dispositivos termoeléctricos se basan en el hecho de que cuando ciertos materiales son calentados, generan un voltaje eléctrico significativo. Por el contrario, cuando se les aplica un voltaje, se vuelven más calientes en un lado, y más fríos en el otro. Los electrones se mueven del extremo caliente del material al extremo frío, creando electrodos positivos y negativos y con ello el voltaje eléctrico. Este efecto, conocido como Peltier–Seebeck, es reversible. Esto no se produce en todos los materiales ya que, por ejemplo, el filamento de las bombillas incandescentes produce calor al aplicarle una diferencia de voltaje (efecto Joule), pero no es un efecto reversible" a esto se le llama efecto termoeléctrico.
FUENTE: Ciencia e Ingeniería, obtenido de: