La ecuación de Clapeyron es una de esas relaciones, y permite determinar
el cambio de entalpía asociado con un cambio de fase (como la entalpía de
vaporización hfg) a partir sólo del conocimiento de datos de P, v
y T. Considerando la tercera relación de Maxwell:
Durante un proceso
de cambio de fase, la presión es la de saturación, que depende sólo de la
temperatura y es independiente del volumen específico. Es decir, Psat = f
(Tsat). Por lo tanto, la derivada parcial (∂P/∂T)v puede
expresarse como la derivada total (dP/dT)sat, que es la pendiente de la
curva de saturación sobre un diagrama P-T en el estado de
saturación especificado. Esta pendiente no depende del volumen específico, por
lo que puede tratarse como una constante durante la integración de la ecuación
entre los dos estados de saturación a la misma temperatura. En un proceso
isotérmico de cambio de fase líquido-vapor, por ejemplo, la integración produce
La cual se define
como ecuación de Clapeyron en honor al ingeniero y físico francés E.
Clapeyron (1799-1864). Es aplicable a cualquier proceso de cambio de fase que
suceda a temperatura y presión constantes. Se expresa en una forma general como
donde los subíndices 1 y 2 indican
las dos fases.
También puede
simplificarse para cambios de fase líquido-vapor y sólido-vapor con algunas
aproximaciones. A bajas presiones, vg >> vf, por lo que vfg
= vg. Si se considera el vapor como un gas ideal, se tiene vg =
RT/P. Al sustituir estas aproximaciones en la ecuación, se
encuentra
En pequeños
intervalos de temperatura, hfg puede considerarse como una constante en
algún valor promedio. Entonces, al integrar esta ecuación entre los dos estados
de saturación se obtiene
Esta ecuación se
llama ecuación de Clapeyron-Clausius, y puede emplearse para determinar
la variación de la presión de saturación con la temperatura. También se utiliza
en la región sólido-vapor cuando se sustituye hfg por hig (la
entalpía de sublimación) de la sustancia.
FUENTE: Cengel, Yunus .A. & Boles, Michael A. (2011). Termodinámica. México: Mcgraw - Hill




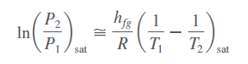

Que carajos es vg, vf y vfg=vg??????????
ResponderEliminarjajaajaja nadie te constesto
Eliminarx2 xddddd
EliminarYo creo que ya ni lo necesitas jajaj pero aún así.
Eliminarvf: volúmen específico de un líquido saturado.
vg: volúmen específico de un vapor saturado.
vfg: diferencia entre vg y vf (vfg = vg - vf).
Ya hasta se graduó el prro JAJAJAJ
EliminarQue buen servicio JAJAJA
ResponderEliminar